LG화학(051910)이 주력으로 개발하던 통풍치료제 '티굴리소스타트'의 글로벌 임상 3상시험을 중단하며 국산 39호 신약 후보군이 좁혀졌다.
30일 제약·바이오업계에 따르면 LG화학은 최근 통풍 치료제 ‘티굴릭소스타트(LC350189)’의 글로벌 임상 3상을 자진 중단한다고 밝혔다. 티굴릭소스타트는 LG화학이 LG생활건강때부터 개발해 온 계열 내 최고(베스트 인 클래스) 신약이다. 2022년 한국, 미국, 유럽 등 21개 국가에서 임상 3상을 승인 받아 올해 임상이 마무리될 예정이었다.
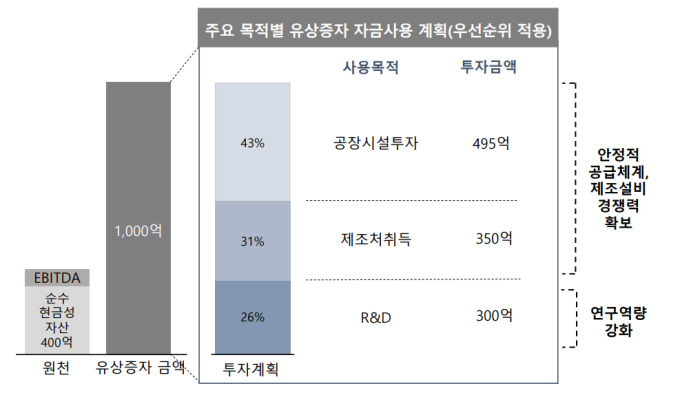
LG화학은 개발을 완료 하더라도 투입 비용 대비 수익성이 떨어질 수 있다는 판단에 이 같은 결정을 내렸다고 설명했다. 회사 관계자는 “통풍치료제는 지난해 위약 대비 우월성을 확인했지만 미국 시장조사 결과 투자비용 회수 등 경제성 측면에서의 불확실성이 커짐에 따라 임상 개발을 중단하기로 결정했다”고 말했다. 티굴릭소스타트 3상에는 현재까지 2000억 원이 넘는 자금이 투입되고 상업화를 위해서는 현재까지 투자한 자금보다 더 많은 투자가 이뤄져야 하는 것으로 전해졌다.
마지막 임상이 진행 중이던 티굴리소스타트 개발이 중단되며 39호 국산 신약 주인공에 업계 관심이 쏠리고 있다. 39호 국산 신약으로는 현재 식품의약품안전처에 품목허가를 신청한 SK바이오팜(326030)의 뇌전증 치료제 ‘세노바메이트’와 큐로셀(372320)의 ‘림카토’가 주목받고 있다.
SK바이오팜의 세노바메이트는 2020년 미국, 2021년 유럽 등에서 출시된 뇌전증 신약이다. 총 누적 처방 환자 수는 14만 명으로 업계에서는 글로벌 시장에서 효과와 안전성을 인정받은 만큼 국내 허가에 큰 무리가 없을 것이라는 관측이 나온다. 국내와 중국, 일본 등에서 아시아인 18~70세 성인 국소 발작 뇌전증 환자를 대상으로 임상 3상도 마무리된 상태다. 국내에서는 동아ST가 라이선스인 계약을 맺고 지난달 20일 식약처에 품목허가를 신청한 상태다. 국내 판매도 동아ST가 담당한다.
큐로셀의 림카토도 올해 국산 신약 허가가 주목된다. 림카토는 보건복지부의 ‘허가·평가·협상 병행 시범사업’에도 선정됐다. 식약처의 허가 신청 단계부터 급여 평가, 약가 협상까지 동시에 이어지게 돼 기존 절차보다 빠른 일정으로 출시될 것으로 전망된다. 큐로셀은 지난해 12월 30일 식약처에 림카토 품목 허가를 신청했으며 올해 2월에는 건강보험심사평가원에 건강보험 급여등재를 위해 약제급여평가를 신청했다. 업계에서는 빠르면 상반기 중 품목허가가 이뤄질 것으로 기대하고 있다. CAR-T 치료제는 환자의 면역T세포 유전자를 채취한 후 암세포에 특이적으로 반응하는 CAR를 발현시키는 등 조작을 한 후 다시 환자에게 주입해 암세포를 사멸시키는 항암제다.
한편 지난해에는 온코닉테라퓨틱스의 자큐보정과 비보존제약의 어나프라주가 식품의약품안전처로부터 국산 신약으로 승인을 받았다. 37호 국산 신약인 자큐보정은 제일약품 자회사인 온코닉테라퓨틱스가 개발한 위식도역류질환 치료제로 지난해 4월 식약처 허가를 받았다. 이어 12월에는 비보존제약의 비마약성 진통제 어나프라주가 38호 신약으로 허가를 받으면서 한 해 두 개의 국산 신약이 탄생했다.