디지털치료제로 불리는 소프트웨어(SW) 의료기기, 인공지능(AI) 등 첨단 디지털 기술을 접목한 의료기기에 대한 규제 기준을 담은 ‘디지털의료제품법’이 올해부터 시행된다. 디지털 의료기기에 대한 규제 기준을 설정하려는 시도가 국내는 물론 전 세계적으로도 처음이라는 점에서 업계 안팎의 관심이 높다. 식품의약품안전처는 적절한 규제 기준을 설정함으로써 제품 품질 향상은 물론 신규 시장 형성, 국제 경쟁력 강화까지 도모한다는 청사진을 내놓았다. 오는 2027년 3조 8000억원 규모까지 성장할 것으로 전망되는 디지털헬스시장에 미칠 영향이 주목된다.
1일 식약처와 업계에 따르면 24일부터 시행되는 디지털의료제품법은 디지털 의료기기의 임상시험, 제조·수입 등 허가, 사후관리 등 전반에 대한 취급과 관리 및 지원에 필요한 사항을 규정하고 있다. 제품의 발전을 위한 디지털 의료제품 영향평가, 디지털 의료제품 구성요소에 대한 성능평가, 연구개발(R&D) 및 표준화 지원, 전문인력 양성, 국제협력 등에 대한 근거를 담았다. 법 적용을 받는 범위는 디지털센서, 모바일 앱 등 디지털 의료기기 뿐만 아니라 약품과 함께 사용함으로써 효능과 안정성을 높여주는 디지털 융합 의약품까지 포함된다. 의료기기는 아니지만 생체 신호를 측정 및 분석하거나 생활습관을 기록한후 분석해 건강관리 정보를 제공하는 디지털 의료·건강지원 기기도 법 적용 대상이다.
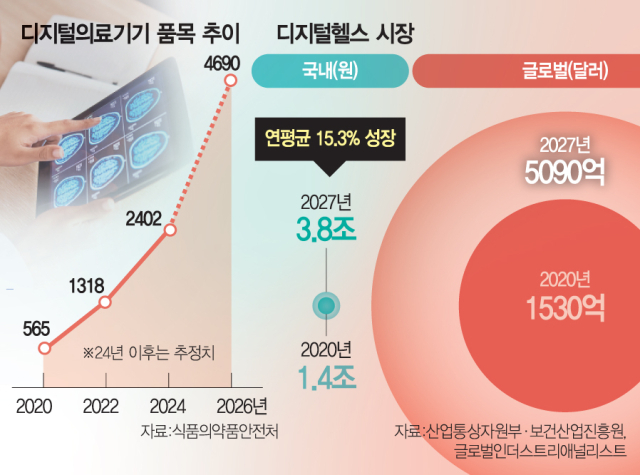
산업통상자원부, 한국보건산업진흥원 등에 따르면 국내 디지털헬스 시장 규모는 2020년 1조 4000억 원에서 2027년 3조 8000억 원으로 연 평균 15.3% 성장할 것으로 전망된다. 글로벌 시장은 더욱 가파르게 성장할 것으로 예상된다. 시장조사기관 글로벌인더스트리애널리스트(GIA)는 글로벌 디지털헬스 시장 규모가 2020년 1530억 달러에서 2027년 5090억 달러까지 커질 것으로 내다봤다.
식약처는 디지털의료제품법의 구체적인 내용을 보충할 시행령과 시행규칙, 디지털의료제품 평가 가이드라인과 각종 고시들까지 제정할 등 준비를 마쳤다. 식약처는 디지털의료제품법이 성공적으로 정착되면 국내 디지털 의료기기 품목은 2023년 1751개에서 2026년 4690개로 급증하고 디지털 융합 의약품과 디지털 의료·건강지원 기기는 2026년 각각 240개, 2345개에 달할 것으로 전망했다. 오유경 식약처장은 “디지털헬스의 큰 틀 안에서 다양한 의료기기, 의약품, 건강지원기기의 융합 생태계 구축을 위해 제품 특성에 맞는 규제 체계를 세계 최초로 마련했다는 점에서 의의가 있다”고 설명했다.
가장 눈에 띄는 부분은 향후 4년간 약 124억원을 투입하는 ‘디지털 의료제품 안전관리 강화’ 사업이다. 안전관리 평가 가이드라인에 따라 디지털 의료제품 우수관리체계 인증을 대행할 기관과 규제지원센터를 설치하게 된다. 인증 대행기관은 디지털 의료기기의 품질관리, 소비자 안전관리, 전자적 침해행위 예방 및 대응체계 등을 평가해 우수 관리체계 인증을 진행한다. 디지털 의료기기 제조·수입업자의 SW에 대한 품질관리기준 적합 여부도 판정한다. 규제지원센터는 공공기관, 권역별 디지털헬스기기 평가기관 등과 연계해 임상시험 등 디지털 의료제품 실사용 평가, 결과보고서 작성 등을 지원한다. 사이버보안 설계, 사용자 적합성 평가 등 시판 전 성능평가와 실제 사용 환경의 가치평가를 지원하고 전문가 양성 교육도 실시한다.


![[AI PRISM*스타트업 뉴스]3700억 K뷰티·100만 1인창업 시대…AI제조혁신으로 경쟁력 강화](https://newsimg.sedaily.com/2025/01/04/2GNKA84UDX_1.jpg)