임상 1상 진행 상황 공개
[서울=뉴스핌] 김신영 기자 = HLB이노베이션은 미국 자회사인 베리스모 테라퓨틱스가 지난 3일(현지시간) 폐막한 '미국임상종양학회(ASCO) 2025'에서 고형암 대상 차세대 CAR-T 치료제 후보물질 'SynKIR-110'의 임상 1상(STAR-101) 진행 상황을 '진행 중 임상(Trials in Progress)' 포스터 발표를 통해 공개했다고 5일 밝혔다.
이번 발표는 STAR-101 임상을 주도하는 펜실베이니아대학교(UPenn) 펄먼 의과대학의 야노스 타니이(Janos L. Tanyi) 교수가 맡아, SynKIR-110의 과학적 근거와 임상 설계, 환자 선정 기준, 주요 안전성 평가 항목 등을 소개했다.
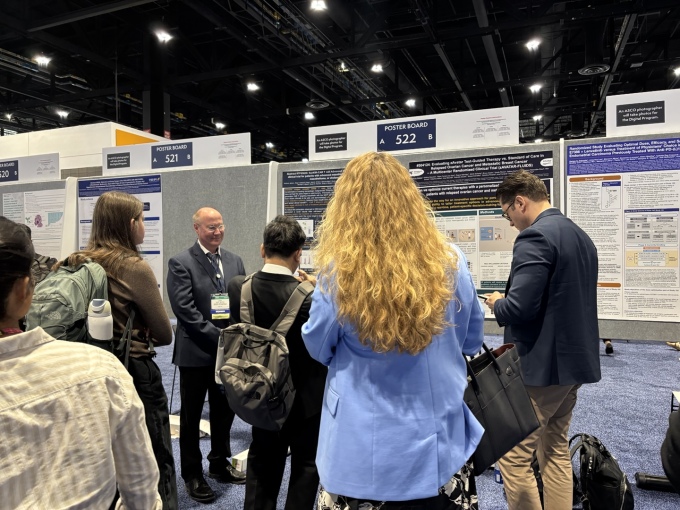
STAR-101 임상은 메소텔린이 과발현된 중피종, 담관암, 난소암 환자 중 최소 1차 이상 전신 치료를 받은 재발 환자를 대상으로 한 최초 인체 대상(first-in-human) 임상시험이다. 미국 내 다기관에서 공개 방식으로, 단계적 용량 증량(3+3 디자인) 구조로 진행되고 있다.
해당 임상은 2022년 9월 미국 식품의약국(FDA)으로부터 임상시험계획(IND) 승인을 받았으며, 같은 해 10월에는 중피종 적응증에 대해 희귀의약품 지정(ODD)을, 2023년에는 신속심사 대상으로 지정받았다.
SynKIR-110은 최초의 CAR-T 치료제 '킴리아'를 개발한 UPenn 연구팀이 고안한 KIR-CAR 플랫폼을 기반으로 한다. 이는 NK세포 수용체 구조를 모방한 멀티체인 수용체를 T세포에 발현시켜, 기존 CAR-T의 한계를 개선한 차세대 기술로 평가받고 있다.
특히 이번 STAR-101 임상에서는 현재까지 코호트 3까지 환자 투여가 진행됐으며, 모든 투여가 용량제한독성(DLT) 없이 완료된 것으로 나타났다. 업계에서는 CAR-T 치료제 상용화가 이뤄진 적 없는 고형암 분야에서 진행 중인 임상이라는 점에서 높은 주목을 받고 있다.
베리스모는 이번 임상을 통해 임상 2상 권장용량(RP2D)을 도출한 뒤, 적응증별 초기 유효성 평가를 위한 확장 코호트를 진행할 예정이다. CAR-T 치료제의 경우, 임상 3상 비교시험이 어려워 2상 종료 후 신약허가 신청이 가능하다는 특성을 지닌다.
브라이언 김 HLB이노베이션 및 베리스모 대표는 "SynKIR-110은 기존 CAR-T 치료의 한계를 극복해 고형암 치료에 새로운 가능성을 제시할 수 있는 잠재력을 지닌 후보물질로 획기적인 치료옵션이 부재한 중피종, 담관암, 난소암에서 의미 있는 대안이 될 수 있을 것으로 기대된다"며 "현재 임상 1상이 순조롭게 진행되고 있는 만큼, 빠르게 임상 2상에 진입하기 위해 2상 설계와 상업화용 제조 공정 개발을 글로벌 위탁개발·생산(CDMO) 업체 등과 긴밀히 진행 중"이고 밝혔다.
sykim@newspim.com




![삼천당제약, 아일리아 바이오시밀러 첫 수출에 주가 10% '쑥' [Why 바이오]](https://newsimg.sedaily.com/2025/06/05/2GTYF839OW_1.jpg)
