신종 펜데믹 대응을 위한 메신저리보핵산(mRNA) 백신 개발 지원사업이 올해 말 임상 연구에 들어간다. 2028년 국산 코로나19 백신 제품 허가를 목표로 연구개발(R&D) 지원에 속도를 낸다.
질병관리청은 최근 펜데믹 대비 백신 개발 사업 임상 지원 과제에 대한 사전 의견수렴 절차를 진행했다. 코로나19 mRNA 백신 후보물질 발굴을 위한 임상 1상 시험을 시행하는 이번 사업에는 총 2개 산·학·연·병 컨소시엄을 선발한다. 올해 12월부터 2027년 3월까지 16개월의 연구 기간 컨소시엄당 약 70억원의 R&D 비용을 지원한다.
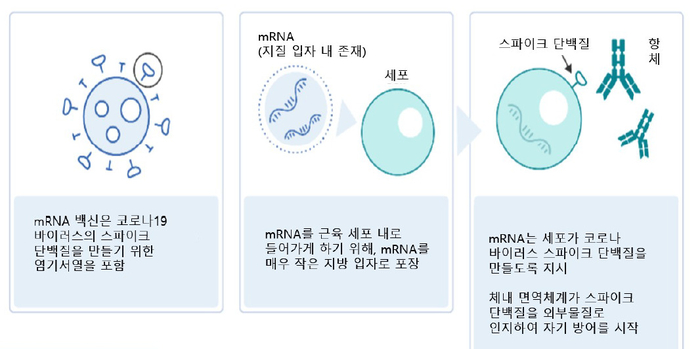
이번 임상 과제는 팬데믹 대비 mRNA 백신 개발 지원사업의 두 번째 연구 단계다. 질병관리청은 감염병 대유행 시 mRNA 기술을 활용해 100일 또는 200일 이내에 백신을 개발하기 위해 이번 사업을 추진했다. mRNA는 바이러스 등에 대항하는 단백질을 만드는 법을 인체에 알려주는 유전 물질이다. 바이러스 유전자 정보만 알면 mRNA 백신을 신속하게 설계·생산할 수 있다.
코로나19 유행 시기 보통 10년이 넘게 걸리던 백신 개발을 mRNA 플랫폼 기술로 11개월 만에 상용화하며 세계는 mRNA 백신 기술 확보에 나서고 있다. 우리나라도 지난 3월 국가연구개발사업평가 사업계획 적정성 검토를 통과하며 본격적인 연구에 착수했다. 2028년까지 mRNA 백신 제품 허가를 목표로 비임상부터 임상3상까지 네 단계로 나눠 사업을 운영한다. 4년간 총 5052억원을 투입하는 대규모 사업이다. 비임상 과제는 녹십자, 레모넥스, 유바이오로직스, 한국비엠아이 등 네 곳이 지난 4월 수행기관으로 선정됐다.
이번 임상 1상 연구는 코로나19 mRNA 백신 후보물질의 인체 내 안전성과 면역원성 등을 탐색하는 데 초점을 맞췄다. 건강한 사람을 대상으로 접종 전후의 혈청 변화를 비교하고, 제조·품질관리기준(GMP)에 기반해 표준화된 생산공정 등을 확보한다. 임상 2상을 위한 임상시험계획(IND) 승인을 이번 연구 성과 목표로 제시했다. 국산 mRNA 백신 상용화가 목표인 만큼 백신 타겟은 LP.8.1, JN.1, KP.2 등 세계보건기구(WHO)의 최신 권고주로 한정한다. 질병관리청은 사전 의견수렴 절차를 마치고 조만간 확정된 과제를 공고한다.
질병관리청은 내년과 2027년 각각 임상 2상, 3상 R&D도 시작하며 2028년 국산 mRNA 백신 개발까지 속도감 있게 사업을 추진한다. 사업에 참여하는 민간 기관이 부담하는 연구개발비를 감축하고, 개발 단계마다 백신 후보물질의 효과성과 안전성 등을 비교·평가해 국민이 안심하고 접종할 수 있는 mRNA 백신을 선보일 계획이다.
질병관리청 관계자는 “팬데믹 발생 시 국내 기술과 역량으로 신속히 백신을 개발해 국민 생명을 보호하고 사회·경제적 손실을 최소화하겠다”면서 “코로나19 백신 안정적 수급은 물론 mRNA 기술을 활용한 감염병, 암 치료 등 고부가가치 시장개척을 기대한다”고 말했다.
송윤섭 기자 sys@etnews.com