미국 식품의약국(FDA)의 바이오시밀러 승인 속도가 2년 사이 급격히 빨라지고 있다. 블록버스터 의약품 특허 만료가 본격화되고, 고비용 의약품에 대한 부담으로 바이오시밀러 수요가 커지면서 승인 건수가 매년 증가하는 추세다.
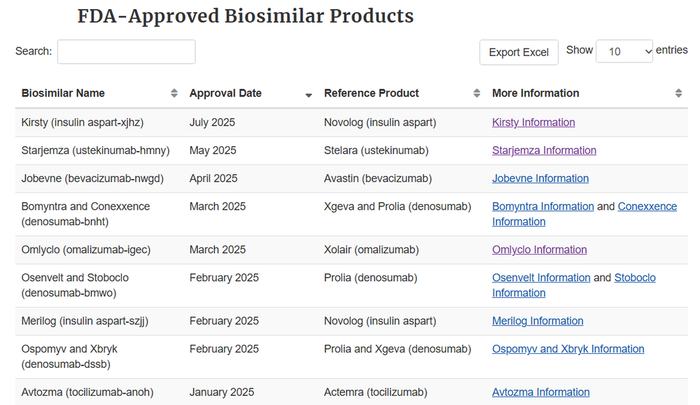
13일 FDA에 따르면 2021년 4건이었던 바이오시밀러 승인 건수는 2022년 7건, 2023년 5건으로 완만히 늘었다. 그러다 지난해 18건이 승인되며 사상 최대를 기록했다. 올해는 8월 현재 이미 12건의 바이오시밀러가 허가를 받았다.
지난해 승인된 18건 중 국내 제품은 4건이다. 동아에스티의 이뮬도사(스텔라라 바이오시밀러)를 포함하면 5건이다. 올해 승인된 12건 중 한국 제품은 셀트리온의 '옴리클로(졸레어 바이오시밀러)' 1개다.
바이오시밀러 승인이 늘어난 이유는 블록버스터 오리지널 의약품 특허 만료가 이어진 영향이 크다. 자가면역질환 치료제 휴미라, 스텔라라, 황반변성 치료제 아일리아, 골다골증 치료제 프롤리아 등 다수의 고매출 오리지널 의약품 특허가 만료됐다. 이 시장에 바이오시밀러가 침투하면서 승인이 활발해졌다.
FDA가 2018년부터 '바이오시밀러스 액션 플랜(BAP)'으로 심사 절차를 단순화하고 가이드라인 명확화, 사전상담 강화 등을 발표한 것도 승인 속도를 높였다. BAP 이후 FDA가 외국 제조사와 사전 미팅·자료 제출 방식을 간소화하면서, 한국·유럽 기업들이 미국 시장용 바이오시밀러 개발에 적극적으로 나섰다. 2019~2020년 개발에 착수한 바이오시밀러가 2024년부터 승인이 늘었다.
약국에서 오리지널 의약품처럼 대체 처방이 가능한 '인터체인저블' 지정 확대도 바이오시밀러 시장 진입을 가속화했다. 바이오시밀러는 오리지널 대비 30% 이상 저렴해 환자의 약가 부담 완화 효과가 크다.
시장조사기관 인사이트마켓리서치컨설팅 그룹에 따르면 글로벌 바이오시밀러 시장 규모는 2024년 기준 약 265억 달러에서 연평균 24.5% 성장해 2033년에는 1851억 달러에 이를 것으로 전망된다.
한편 FDA는 지난 2015년부터 2025년 현재까지 총 72건의 바이오시밀러를 허가했다.
송혜영 기자 hybrid@etnews.com
![머크向 기술 수출 수익 확대 기대…알테오젠 순매수 1위[주식 초고수는 지금]](https://newsimg.sedaily.com/2025/08/12/2GWLIOG2CR_1.png)