
코스닥 상장을 추진했다가 투자자 반발에 가로막혀 철회한 제노스코가 다시 한 번 신약 개발 도전에 나선다. 제노스코는 국내 최초 미국 식품의약국(FDA) 승인 항암제 ‘렉라자’의 원개발사다.
오스코텍(039200)의 자회사 제노스코는 특발성 폐섬유증 치료제로 개발 중인 ROCK2 억제제 후보물질 ‘GNS-3545’ 임상 1상 임상시험계획(IND)을 미 FDA에 제출했다고 2일 밝혔다. 이번 임상은 건강한 지원자를 대상으로 안전성과 내약성을 평가하는 초기 임상 연구다. IND 승인이 이뤄지면 연내 임상 1상을 시작할 예정이다.
제노스코는 올 4월 한국거래소로부터 기술특례상장 예비심사 결과 미승인 통보를 받은 뒤 이번에 다시 신약 개발에 나서는 것이다. 모회사 오스코텍과 공동개발한 렉라자를 글로벌 기술이전한 성과를 냈지만 모회사 오스코텍 주주들의 ‘중복상장’ 반발에 부딪혀 결국 상장을 철회했었다.
제노스코에 따르면 GNS-3545는 섬유화를 유발하는 핵심 단백질의 발현을 효과적으로 억제했고, 동물 대상 전임상 시험에서 질병 관련 유전자 발현을 정상 수준으로 회복시켰다. 회사 관계자는 “손상된 폐 조직의 회복 가능성을 보여주는 것”이라며 “질병 진행을 늦추는 데 그쳤던 기존 치료제와 달리 근본적인 치료가 가능하다는 의미”라고 설명했다.
제노스코는 이번 IND 제출이
고종성 제노스코 대표는 “이번 임상 1상 진입은 제노스코의 신약 개발 역량을 다시 한 번 확인시켜주는 중요한 이정표가 될 것”이라며 “렉라자에 적용한 것처럼 임상개발 후보물질이 갖춰야 할 엄격한 내부 기준을 통과해 선별된 물질인 만큼 향후 성과에 대한 기대가 크다”고 말했다.
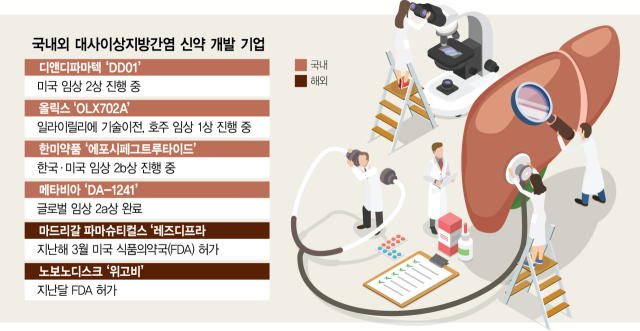
![[단독]HK이노엔, MASH 치료제 개발 전략 재검토](https://nimage.newsway.co.kr/photo/2025/09/02/20250902000008_0700.png)
![에이비엘바이오 'ABL301', 최초 IGF1R 타깃 BBB셔틀 개발 의미 커 [Why 바이오]](https://newsimg.sedaily.com/2025/09/02/2GXQTXNXYF_1.jpg)




![[GAM] 트럼프식 국유화? 지분 수집 또 어디 ③의약 2곳 거론](https://img.newspim.com/etc/portfolio/pc_portfolio.jpg)