3상 임상시험 종료 … 이달 12일 최종 피험자 관찰 마쳐
‘나보타’와 경쟁 전망 … 글로벌 진출·신제품 개발도 활발
휴온스그룹이 전략 보툴리눔톡신 제제 ‘리즈톡스’의 양성교근비대(사각턱) 임상을 모두 마쳤다. 현재 동일 적응증을 보유한 제품은 대웅제약의 ‘나보타’가 유일해서 두 제품 사이의 점유율 경쟁이 본격화할 전망이다.
26일 식품의약품안전처에 따르면, 휴온스그룹의 보툴리눔톡신 사업 자회사인 휴온스바이오파마는 지난 12일 ‘리즈톡스(수출명 : 휴톡스)’의 사각턱 3상 임상시험의 최종 피험자 관찰을 끝내고 최근 임상 진행 상태를 종료로 변경했다.
이번 임상시험은 양성교근비대증 개선이 필요한 만 19세 이상 성인을 대상으로 ‘리즈톡스’의 안전성과 유효성 평가하기 위해 진행했다. 지난 2013년 임상시험계획을 승인받아 같은 해 7월 첫 피험자를 등록했다. 최종 피험자는 지난해 12월 선정됐으며, 약 1년간 약물 투약 및 평가를 진행했다.
데이터 분석 및 허가 절차에 걸리는 시간을 고려할 때, ‘리즈톡스’는 이르면 내년 양성교근비대증 개선 적응증 확보가 가능할 것으로 점쳐진다.
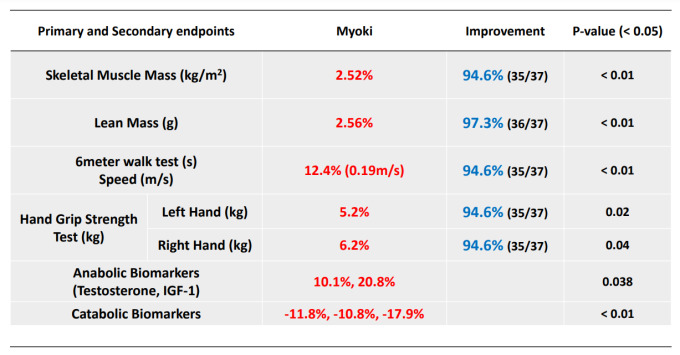
3상 임상시험의 1차 평가변수는 ‘리즈톡스’ 투여 후 12주 시점에 초음파를 통해 측정한 최대 교합 시의 양측 교근 두께의 평균 변화량이다. ‘리즈톡스’는 앞서 진행한 2상 임상시험에서 양성교근비대증 개선 효과를 확인한 바 있다. 기존 보툴리눔톡신 A형 제제와 안전성 비교에서 특이사항이 관찰되지 않았다.
양성교근비대증 개선 영역에서 보툴리눔톡신은 최소 침습적 방법으로 직접 교근에 투여, 비교적 간단한 절차로 보존적, 수술적 치료를 대체 사용될 수 있는 만큼, 관련 적응증 획득 후 ‘리즈톡스’의 경쟁력은 한층 높아질 것으로 휴온스바이오파마는 내다보고 있다.

휴온스바이오파마는 현재 보툴리눔톡신 제제 시장의 요구에 맞춰 ‘리즈톡스’의 적응증 확대와 글로벌 시장 진출, 그리고 신규 보툴리눔톡신 제제 개발에 공을 들이고 있다.
이 회사는 지난해 ‘리즈톡스’의 뇌졸중 후 상지근육 경직 치료 적응증 3상 임상시험을 끝내고 식약처에 허가 신청서를 제출했다. 글로벌 진출 시도도 활발히 이뤄지고 있는데, 미국, 유럽과 함께 세계 3대 보툴리눔톡신 제제 시장으로 꼽히는 중국에서 허가 절차를 진행 중이다. 미국과 유럽에서는 파트너사 물색을 마치고 현지 진출을 준비하고 있다.
휴온스바이오파마는 내성 발현을 줄인 차세대 보툴리눔톡신 제제 ‘HU-045’의 개발도 막바지에 이르렀다.
휴온스바이오파마는 지난달 ‘HU-045’의 국내 3상 임상시험 피험자 모집을 종료했다. 지난 6월 첫 피험자 모집 이후 4개월여 만에 최종 피험자 선정이 이뤄진 것으로, 앞으로 반년여 간의 평가 기간을 거쳐 시험을 마무리할 예정이다.
‘HU-045’는 내성 발생 가능성을 낮추기 위해 휴온스바이오파마가 개발 중인 신규 보툴리눔톡신 제제이다. 비독소 단백질을 제거하고 신경독소 단백질 150kDa 크기의 신경독소를 정제해 중화항체 형성 가능성을 낮췄다.
휴온스바이오파마는 이번 임상시험에서 ‘HU-045’와 독일 멀츠(Merz)의 ‘제오민’(Xeomin)을 비교 평가해 유효성과 안전성을 입증한다는 목표다.
업계 관계자는 “휴온스바이오파마는 보툴리눔톡신 제제 사업이 본궤도에 오르면서 바이오 3공장도 건설 중”이라며 “바이오 3공장 완공 후 생산역량을 늘려 ‘리즈톡스’의 해외 진출을 본격화할 계획”이라고 말했다.